Oryzon anuncia sus resultados y avances en el cuarto trimestre de 2019
MADRID, ESPAÑA y CAMBRIDGE, EE.UU., 24 de Febrero de 2020 – Oryzon Genomics, S.A., la compañía española que desarrolla terapias experimentales epigenéticas innovadoras, anuncia sus resultados y avances en el cuarto trimestre de 2019.
EVOLUCIÓN DEL NEGOCIO
Las inversiones realizadas en I+D de 11,3 M€ hasta el cuarto trimestre de 2019 han permitido a Oryzon avanzar significativamente en su cartera clínica.
CUARTO TRIMESTRE DE 2019
Iadademstat en oncología:: En este cuarto trimestre, Oryzon ha continuado reclutando pacientes en los estudios clínicos en curso con iadademstat (ORY-1001) tanto en leucemia como en cáncer de pulmón de células pequeñas (CPCP).
ALICE es un estudio de Fase II de un solo brazo que evalúa la seguridad y la eficacia clínica de iadademstat en combinación con azacitidina en pacientes ancianos con leucemia mieloide aguda de primera línea que no son elegibles para la terapia convencional. Tras la presentación inicial de datos preliminares de este estudio en la Conferencia de la Asociación Europea de Hematología (EHA-2109), la compañía presentó nuevos datos de eficacia de este estudio en la 61ª Conferencia Anual de la Sociedad Americana de Hematología, ASH-2019, en Orlando, EE.UU. en Diciembre de 2019. La combinación de iadademstat con azacitidina continuó mostrando ser bien tolerada, y presento signos prometedores de actividad clínica. Hubo respuestas objetivas (OR) en 6 de 8 pacientes evaluables (75% OR): de éstas, hubo 2 remisiones completas (CR), 3 remisiones completas con recuperación hematológica incompleta (CRi) y 1 remisión parcial (PR). ). El tiempo medio de seguimiento entre los pacientes evaluables fue de 20 semanas, con un tiempo medio de respuesta (TTR) de solo 32 días en PRESS RELEASE 2020 aquellos pacientes que respondieron. Dos de los 5 pacientes (40%) que habían recibido más de 3 ciclos de tratamiento también se habían vuelto independientes de transfusiones (es decir, no requerían transfusiones periódicas de glóbulos rojos).
CLEPSIDRA es un ensayo de Fase II de un solo brazo para evaluar la seguridad y la eficacia clínica de iadademstat en combinación con platino/etopósido en pacientes con CPCP de segunda línea. Los pacientes reciben de 4 a 6 ciclos de la combinación a criterio del investigador y posteriormente el tratamiento puede continuar con iadademstat en monoterapia. Los pacientes son examinados para determinar la presencia de ciertos biomarcadores tumorales de respuesta al fármaco identificados y patentados por la compañía y esta presencia de biomarcadores es utilizada como criterio de inclusión. En Septiembre, la compañía presentó datos preliminares iniciales de los primeros 8 pacientes de este ensayo clínico evaluables para eficacia en la conferencia ESMO celebrada en Barcelona. La combinación de iadademstat más carboplatino-etopósido presentó resultados prometedores de eficacia clínica, con un 75% de respuestas observadas (6 de 8 pacientes): 4 remisiones parciales y 2 estabilizaciones de la enfermedad de larga duración. Una de las remisiones parciales era una respuesta de larga duración, con el paciente en ciclo 13 y siguiendo en remisión. Este paciente mostró inicialmente un 78,7% de reducción de tumor según criterios RECIST; después del tratamiento con la combinación, el paciente recibió tratamiento con iadademstat en monoterapia y la tolerabilidad mejoró sustancialmente mientras que continuó la reducción de las lesiones principales y secundarias, con un 86,3% de reducción de tumor por criterios RECIST al final del ciclo 12. La toxicidad reportada más prevalente en el tratamiento con la triple combinación iadademstat más carboplatino-etopósido fueron alteraciones hematológicas; la combinación no presentó toxicidad neurológica, hepática o renal. Iadademstat en solitario no produjo toxicidad hematológica ni de ningún otro tipo en los pacientes estudiados hasta ese momento y fue capaz de producir disminución tumoral. El ensayo clínico sigue reclutando pacientes e investigando regímenes de dosificación de la combinación que minimicen la toxicidad hematológica.
Vafidemstat in neurological disease:El desarrollo clínico de vafidemstat (ORY-2001) también ha continuado avanzando en el cuarto trimestre en los diferentess ensayos clínicos en Fase IIa en curso: REIMAGINE y REIMAGINE-AD, que evalúan el efecto de vafidemstat para tratar la agresividad en pacientes en tres enfermedades psiquiátricas - trastorno límite de la personalidad (TLP), trastorno de déficit de atención e hiperactividad (TDAH) y trastorno del espectro autista (TEA) y en enfermedad de Alzheimer (EA) moderada y severa, respectivamente, ETHERAL, en EA leve y moderada, y SATEEN, en esclerosis múltiple (EM).
En Octubre, Oryzon presentó nuevos datos positivos de eficacia humana del ensayo clínico REIMAGINE en la Conferencia Internacional CINP 2019 en Atenas, presentando nuevos datos de las cohortes de TDAH, TLP y TEA, así como datos agregados de las tres cohortes. En cuanto al criterio de valoración primario, seguridad y tolerabilidad, vafidemstat fue seguro y bien tolerado sin efectos adversos significativos en las tres cohortes. En términos de eficacia, después de 2 meses de tratamiento con vafidemstat, se observaron mejoras estadísticamente significativas en varias escalas que miden la agresión, como las escalas de Impresión Clínica Global de Gravedad de la enfermedad (CGI-S) y de Mejoría Global (CGI-I) y en la sub-escala de 4 items de Agresión-Agitación del Inventario Neuropsiquiátrico, NPI (Neuropsychiatric Inventory), tanto en los datos agregados para todos los sujetos como en cada una de las tres cohortes individuales (TDAH, TEA, TLP). También se observaron mejoras en varias escalas que evalúan de manera más general la condición global de los pacientes, como la escala global del NPI, la escala BPD Checklist (BPDCL por sus iniciales inglesas) específica para pacientes con TLP y la Escala de Calificación de TDAH (ADHD-RS por sus iniciales inglesas) específica para pacientes con TDAH. A la vista de estos datos, la compañía está actualmente preparando un PRESS RELEASE 2020 ensayo clínico de Fase IIb en TLP (estudio PORTICO), que espera iniciar durante 1H2020, y evaluando estudios de Fase IIb adicionales en TDAH y/o TEA.
La compañía ha completado el reclutamiento de pacientes en REIMAGINE-AD, con un total de 12 pacientes con EA en estadio moderado o severo agresivos. Siguiendo la recomendación de los investigadores clínicos, se ha extendido la duración del estudio inicialmente prevista de 2 meses a 6 meses con el objeto de determinar mejor no solo el posible efecto del fármaco en la agresividad sino también en otros dominios de la enfermedad que se presentan en este estadio avanzado. La compañía espera presentar resultados de este estudio en la conferencia AAT-AD/PD en Abril de 2020 en Viena, Austria.
ETHERAL es un estudio aleatorizado, de doble ciego, con 3 brazos paralelos, dos brazos con diferentes dosis de principio activo y un brazo placebo control, de 24 semanas de tratamiento seguido de una extensión de 24 semanas más en el que los pacientes con placebo se re-asignan de forma aleatorizada a la terapia con vafidemstat. ETHERAL evalúa la seguridad, la tolerabilidad y eficacia preliminar de vafidemstat en pacientes con EA leve a moderada. Se ha finalizado el reclutamiento de ETHERAL en Europa, con 117 pacientes randomizados, y continúa en el ensayo paralelo en EE.UU. (ETHERAL-US). La compañía presentó datos positivos de seguridad de los primeros 104 pacientes en ETHERAL en la Conferencia Internacional de la Asociación de Alzheimer de 2019 (AAIC-2019) en Los Ángeles (EE.UU.) en julio, lo que sugiere que el medicamento es seguro y bien tolerado en pacientes con EA. La compañía planea presentar resultados preliminares iniciales correspondientes a 6 meses de tratamiento del estudio europeo también en la conferencia AAT-AD/PD en Abril de 2020.
SATEEN es un estudio piloto de Fase IIa con vafidemstat en pacientes de Esclerosis Múltiple, donde los pacientes son tratados con vafidemstat o placebo durante 9 meses en doble ciego seguido de una fase de extensión en abierto de 6 meses adicionales donde todos los pacientes reciben tratamiento con vafidemstat. En Septiembre la compañía anunicó la ampliación de la duración del tratamiento en la fase de extensión en los pacientes con la forma secundaria progresiva de la enfermedad hasta un máximo de 18 meses, con el objeto de evaluar el efecto del fármaco como tratamiento de la enfermedad progresiva, lo que requiere mayor tiempo de observación clínica.
Además, se han realizado progresos en los programas en fases preclínicas.
Información financiera del cuarto trimestre de 2019
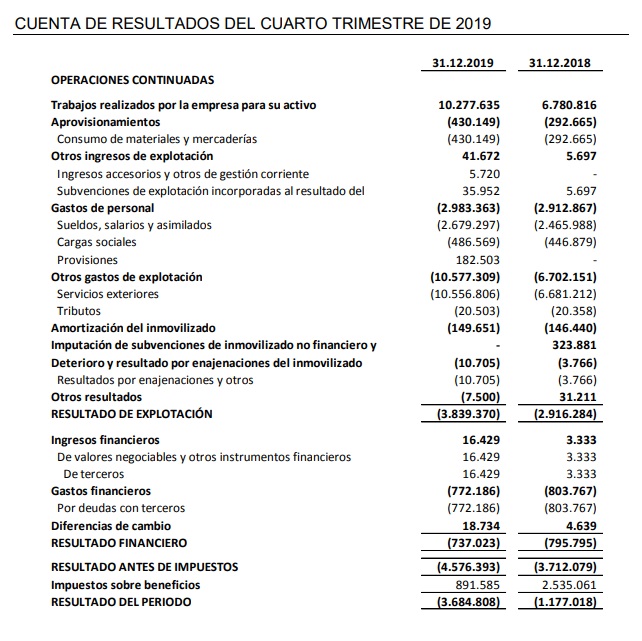
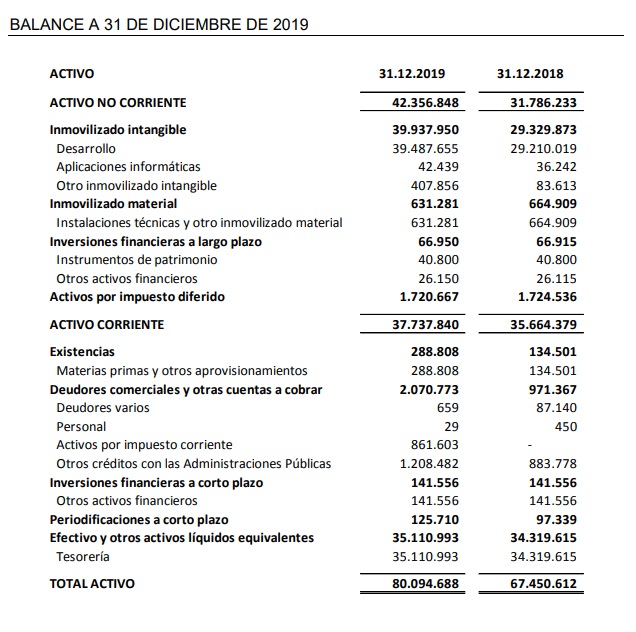
Al cierre del cuarto trimestre de 2019 el efectivo y las inversiones financieras a corto plazo de 35,3 presentan una posición financiera consolidada que debe permitir el desarrollo de las actividades de I+D a lo largo de los próximos trimestres.
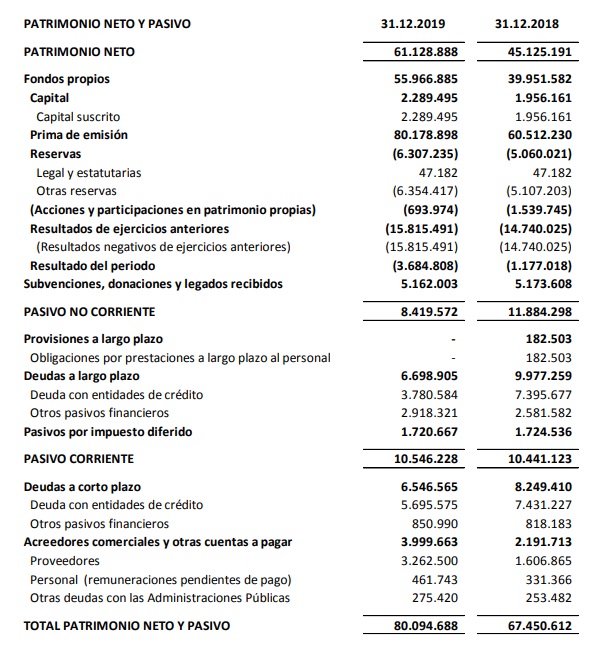
El resultado negativo de 3,7 M€ es acorde a la fase en que se halla el modelo de negocio de la Sociedad. El resultado negativo de 1,2M€ al cierre del ejercicio 2018, incorporaba ingresos no recurrentes de 2,6 M€ correspondientes a monetización de deducciones fiscales por I+D de los ejercicios fiscales 2013 a 2016, frente a los 0,9 M€ reconocidos al cierre del ejercicio 2019. El patrimonio neto de 61,1 M€ supone un incremento de 16M€ con respecto al importe del cuarto trimestre del año anterior, que fue de 45,1 M€.
PRINCIPALES NOTICIAS EN EL CUARTO TRIMESTRE DE 2019
A continuación se relacionan las principales noticias publicadas a lo largo del cuarto trimestre de 2019; la información completa puede consultarse en:
https://www.oryzon.com/es/noticias
3 de octubre de 2019 ORYZON presenta nuevos datos positivos de eficacia de vafidemstat en el tratamiento de la agresión del ensayo REIMAGINE
Oryzon ha presentado nuevos datos positivos de eficacia humana de vafidemstat en el tratamiento de la agresividad del ensayo de Fase IIa REIMAGINE en el marco del congreso del Colegio Internacional de Neuropsicofarmacología, CINP 2019, celebrado en Atenas
9 de diciembre 2019 ORYZON presenta nuevos datos de eficacia de su ensayo clínico de Fase II ALICE que investiga iadademstat en leucemia mieloide aguda
Oryzon ha presentado nuevos datos de su ensayo clínico en Fase II ALICE, que está investigando iadademstat en combinación con azacitidina en pacientes de edad avanzada con leucemia mieloide aguda (LMA). Los datos se presentaron en la 61ª Conferencia Anual de la Sociedad Americana de Hematología, ASH-2019, en Orlando, Florida, EE.UU.
Sobre Oryzon
Fundada en 2000 en Barcelona, España, Oryzon es una compañía biofarmacéutica de fase clínica líder europea en Epigenética. La compañía tiene una de las carteras más fuertes en el sector. El programa LSD1 de Oryzon tiene en la actualidad dos moléculas en ensayos clínicos, iadademstat y vafidemstat. Además, Oryzon cuenta con programas en curso para el desarrollo de inhibidores contra otras dianas epigenéticas. La compañía posee también una fuerte plataforma tecnológica para la identificación de biomarcadores y valida biomarcadores y dianas para una variedad de enfermedades oncológicas y neurodegenerativas. La compañía tiene oficinas en España y EEUU. Para más información, visitar www.oryzon.com
AFIRMACIONES O DECLARACIONES CON PROYECCIONES DE FUTURO
Esta comunicación contiene información y afirmaciones o declaraciones con proyecciones de futuro sobre Oryzon. Asimismo, incluye proyecciones y estimaciones financieras con sus presunciones subyacentes, declaraciones relativas a planes, objetivos, y expectativas en relación con futuras operaciones, inversiones, sinergias, productos y servicios, y declaraciones sobre resultados futuros. Las declaraciones con proyecciones de futuro no constituyen hechos históricos y se identifican generalmente por el uso de términos como “espera”, “anticipa”, “cree”, “pretende”, “estima” y expresiones similares.
Si bien Oryzon considera que las expectativas recogidas en tales afirmaciones son razonables, se advierte a los inversores y accionistas de Oryzon de que la información y las afirmaciones con proyecciones de futuro están sometidas a riesgos e incertidumbres, muchos de los cuales son difíciles de prever y están, de manera general, fuera del control de Oryzon, lo que podría provocar que los resultados y desarrollos reales difieran significativamente de aquellos expresados, implícitos o proyectados en la información y afirmaciones con proyecciones de futuro. Entre tales riesgos e incertidumbres están aquellos identificados en los documentos remitidos por Oryzon a la Comisión Nacional del Mercado de Valores y que son accesibles al público.
Se recomienda no tomar decisiones sobre la base de afirmaciones o declaraciones con proyecciones de futuro, ya que se refieren exclusivamente a la fecha en la que se manifestaron, no constituyen garantía alguna de resultados futuros y no han sido revisadas por los auditores de Oryzon. La totalidad de las declaraciones o afirmaciones de futuro de forma oral o escrita emitidas por Oryzon o cualquiera de sus miembros del consejo, directivos, empleados o representantes quedan sujetas, expresamente, a las advertencias realizadas. Las afirmaciones o declaraciones con proyecciones de futuro incluidas en este documento están basadas en la información a disposición de Oryzon a la fecha de esta comunicación.